Mit Wärme gegen Krebs Wie Hyperthermie Standardtherapien ergänzen kann
Herr Dr. Lindner, was ist Hyperthermie und wo kann sie eingesetzt werden?
Die Hyperthermie ist ein technisches Verfahren, das derzeit vorwiegend zur Behandlung
von Weichgewebssarkomen eingesetzt wird. Im Rahmen von Studien werden aber auch Patienten mit anderen Tumorerkrankungen damit behandelt. Mit Hilfe von elektromagnetischen Wellen
erwärmen wir dabei den Tumor und das umliegende Gewebe auf Temperaturen zwischen 40 und 43 Grad Celsius. Es handelt sich damit also um eine lokoregionäre Therapie. Wir unterscheiden uns damit klar von anderen Anwendungen der Hyperthermie, bei denen der ganze Körper erwärmt wird. Wir überwärmen den Tumor für eine Zeitdauer von etwa 60 Minuten. Durch diese Erwärmung möchten wir andere, parallel stattfindende Therapien besser zur Wirkung zu bringen. Die Hyperthermie alleine genügt also nicht, sie wird immer in Kombination mit anderen
Standardverfahren der Onkologie eingesetzt, also mit der Chemo- oder der Strahlentherapie.
Was bewirkt die Hyperthermie in Kombination mit der Chemo- oder der Strahlentherapie?
Man weiß, dass es gerade in der Kombination mit verschiedenen Zytostatika synergistische
Effekte gibt – dass die Chemotherapie durch die Überwärmung besser anflutet, dass die Perfusion verbessert wird und die chemische Reaktivität des Chemotherapeutikums mit der Zielstruktur besser abläuft – Stichwort Alkylierung. In der Kombination mit der Strahlentherapie wissen wir, dass wir damit die DNA-Reparatur der Zelle hemmen können, sodass ein durch die Strahlung hervorgerufener DNA-Schaden schlechter repariert wird. Dadurch wird wiederum der Effekt der
Strahlentherapie aufgewertet.
Gibt es darüber hinaus eigene Effekte der Hyperthermie?
Wir gehen zusätzlich von einem Immuneffekt aus: Durch sogenannte Hitzeschockproteine, die durch den Stress der Erwärmung produziert werden, präsentiert sich der Tumor dem Immunsystem besser - der Tumor wird immunogener. Außerdem gelangen durch die künstliche Fieberreaktion vermehrt Effektorzellen in das inflammatorische Gewebe. Auch dadurch wird der Tumor dem Immunsystem besser präsentiert.
Warum nutzen Sie gerade Temperaturen von 40 bis 43 Grad?
Es gibt auch Verfahren, die höhere Temperaturen nutzen, wie die Thermo-Ablation, etwa die Radiofrequenz-Ablation bei Leber-Metastasen. Dabei kommt es zu einer direkten Nekrose, also zu einer Zerstörung von Proteinen im stark erwärmten Gewebe. Doch dieses Verfahren ist immer auf ein kleines Volumen beschränkt. Es ist klar abzugrenzen von der Hyperthermie. Wenn wir bei einer parallel zur Hyperthermie stattfindenden Chemotherapie das Blutgefäßsystem durch eine zu hohe Temperatur zerstören und den Tumor koagulieren, verhindern wir den Zugang des Medikaments zum Tumor. Das wäre kontraproduktiv.
40 bis 43 Grad erscheinen nicht besonders viel...
Denken Sie daran, wie es sich anfühlt, wenn Sie Fieber haben. Dann sind 40 Grad kaum zu tolerieren. Patienten mit einem lokalen Tumor an den Beinen oder Armen spüren die Wärme bei der Hyperthermie auch nur dort. Patienten aber, die unter einem Tumor im Bauch- oder Beckenbereich leiden, fangen oft an, stark zu schwitzen. Der Körper kommt dadurch in eine Situation wie in der Sauna – man schwitzt, da mit die Körpertemperatur konstant bleibt. Hyperthermie ist aber nicht immer gleich Hyperthermie. Viele Anbieter im komplementärmedizinischen Bereich nutzen eine sogenannte kapazitive Hyperthermie. Dabei liegt der Patient zwischen zwei Kondensatorplatten, und es entsteht ein elektromagnetisches Feld, allerdings ohne fokussierte Erwärmung. Wir hingegen setzen Systeme mit ringförmigen Applikatoren ein, mit denen wir die gewünschte Temperatur in der Tiefe des Gewebes erreichen. Dies können wir auch mit Hilfe von Temperatursonden messen.
Wie sieht es mit der Verträglichkeit der Therapie aus?
Wir induzieren keine zusätzliche Toxizität. Dadurch ist das Verfahren gut verträglich, und es gibt keine relevanten Nebenwirkungen. Es kann aber für einige Patienten durchaus belastend sein, weil sie sich für die Dauer der 60-minütigen Therapie und der Vorwärmzeit von 30 Minuten in dem Applikator befinden. Damit die Strahlung in den Körper eindringen kann, befindet sich zwischen den Antennen des Geräts und der Körperoberfläche der Patienten ein mit Wasser gefüllter Bolus, ein Wasserkissen. Das Wasser ist zwar warm, was die Patienten als angenehm empfinden. Es erzeugt aber einen gewissen Druck, und dadurch entsteht ein Enge-Gefühl.
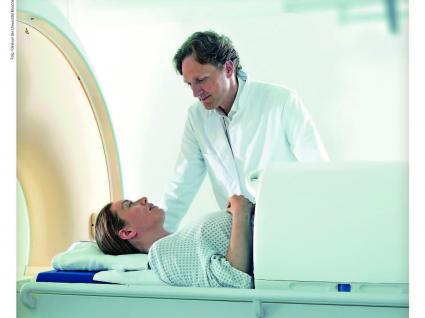
Kann man sich das in etwa so vorstellen, wie bei einer Kernspinuntersuchung?
Im Prinzip ja. Das Kernspin-Gerät ist allerdings oft noch beengender. Der Applikator ist etwa 50 cm lang und befindet sich je nach Lage des Tumors am Bein, im Becken oder im Bauchraum. Das Enge-Gefühl im Applikator ist zwar für manche Patienten unangenehm. Fast alle können aber ohne Sedierung oder andere zusätzliche Maßnahmen behandelt werden. Wie wirksam ist das Verfahren? Für das Weichgewebssarkom konnten wir im Rahmen einer in einer kürzlich in JAMA Oncology veröffentlichten, randomisierten Phase-3-Studie zeigen, dass sich bei Hinzunahme von Hyperthermie zur Chemotherapie ein absoluter Überlebensvorteil von zehn Prozent nach zehn Jahren ergibt. Das konnten wir vor allem für die neoadjuvante Situation zeigen, also für Patienten mit einem lokal fortgeschrittenen Hochrisiko-Weichgewebssarkom. Nach unserer Ansicht wird dies auch in die Leitlinien übernommen werden und damit einen neuen Standard definieren. Daneben gibt es nachgewiesene Indikationen in Kombination mit einer Strahlentherapie für Lokal-Rezidive des MammaKarzinoms im Bereich der Thorax-Wand. Und es gibt mittlerweile sehr gute Daten für die Behandlung von Kindern mit extra-gonadalen Keimzelltumoren. In einer von der Universität Düsseldorf durchgeführten und in Lancet Oncology publizierten Phase-2-Studie wurde gezeigt, dass bei refraktären Patienten, deren Tumoren nicht auf die klassische Chemotherapie ansprechen, durch eine Hinzunahme von Hyperthermie eine Verbesserung des Überlebens erreicht werden kann.
Ist Hyperthermie für andere Indikationen nicht denkbar, oder ist das einfach noch nicht untersucht worden?
Eher letzteres. Wir hoffen auf positive Ergebnisse beim Pankreas-Karzinom. Dazu läuft derzeit eine große adjuvante Studie, die HEAT-Studie, in der die aktuelle Standard-Chemotherapie nach WhippleOperation verglichen wird mit einer Chemotherapie unter Hinzunahme der Hyperthermie. Weitere laufende Studien gibt es für das Rektum-Karzinom in Kombination mit Chemo- und Strahlentherapie und fürs Weichgewebssarkom in Kombination mit Trabectedin. Wir glauben, dass sich diese Therapieform gut in den Kontext aktueller onkologischer Therapien integrieren lässt, und dass sie auch in Zukunft im Rahmen einer immunonkologischen Therapie-Ausrichtung eine wichtige Rolle spielen kann. Hierzu fehlen uns allerdings noch die Daten. In der Immunonkologie werden derzeit sehr viele neue Substanzen geprüft. Was genau passiert, muss die Zukunft zeigen.
Seit wann existiert die Therapie?
Prof. Issels hat sie 1986 hier bei uns in München gestartet. Mithilfe einer Förderung der Deutschen Krebshilfe wurden mehrere Institute in Deutschland mit entsprechenden Geräten ausgestattet und Studien durchgeführt. Die Idee, dass Hyperthermie als natürliche Abwehrreaktion des Körpers bei einer Infektion auch bei Krebserkrankungen hilfreich sein könnte, ist aber schon älter. Sie geht auf die Erstbeschreibung eines New Yorker Chirurgen zurück, der Ende der 1970er Jahre nach einer Infektion im Tumor eine Tumorregression beobachtet hat. Er entwickelte die Idee einer Vakzine, einer Impfung, bei der man infektiöse Erreger in die Tumoren spritzte, um eine Immunreaktion zu induzieren. Das hat in einigen Fällen tatsächlich zu einer Tumorregression geführt, war aber von der Gesamtreaktion der Patienten nicht weiter zu vertreten. Man hat dann angefangen, die Idee systematisch zu untersuchen. Wie das in der Medizin aber leider oft so ist: Therapieprinzipien müssen erst sehr detailliert für die einzelnen Indikationen geprüft werden, und danach ist die Frage:
Wie groß ist das Interesse an den Ergebnissen, und wer führt aus welchem Grund solche Studien durch?
Leider ist das Interesse der Industrie oft größer, pharmakologische Entwicklungen durchzuführen. Ist es denkbar, dass die Hyperthermie irgendwann belastende Chemo- und Strahlentherapien ersetzen kann? Damit ist leider nicht zu rechnen. Man wird aber versuchen, die verwendeten Substanzen mit Hilfe der Hyperthermie noch besser einzusetzen als wir das bisher tun. Hier an der Universität haben wir ein „wärmeempfindliches NanocarrierSystem“ untersucht, mit dem wir Medikamente in eine wärmeempfindliche Hülle einschließen können. Bei Erwärmung auf 40 Grad wird diese Hülle durchlässig und lässt den Wirkstoff austreten. Diese Nanocarrier werden intravenös appliziert, zirkulieren im Körperkreislauf und setzen den Wirkstoff nur dort frei, wo die Temperatur über 40 Grad beträgt. Dadurch erreichen wir zehn- bis 15-fach höhere lokale Wirkspiegel, bei sehr guter allgemeiner Verträglichkeit. Dazu haben wir eine Biotech-Firma in Martinsried gegründet, die Firma Thermosome.
Was müssen zuweisende Ärztinnen und Ärzte beachten?
Zunächst muss natürlich die Indikation überprüft werden und festgestellt werden, ob es Kontra-Indikationen gibt. Dazu zählen in erster Linie Metall-Implantate, wie ein künstliches Hüftgelenk oder ein Metall-Stent, im Hyperthermie-Areal. Denn durch die Mikrowellen-Hyperthermie würde es dort zu einer unkontrollierten Erwärmung kommen. Zur Abklärung besteht auch die Möglichkeit, mit uns telefonisch oder per E-Mail Kontakt aufzunehmen. Die gesetzlichen Krankenkassen bezahlen die Hyperthermie bei den nachgewiesenermaßen wirksamen Indikationen.
Welche Rolle spielen neue Entwicklungen wie die Immunonkologie in der Krebstherapie?
Wir kommen immer mehr weg von rein entitätsorientierten hin zu eher signalwegorientierten Therapien, die wir über die verschiedenen Entitäten hinweg einsetzen können. In den letzten Jahren haben in der Immunonkologie beispielsweise sogenannte „Immun-Checkpoint-Inhibitoren“ Einzug gehalten, mit denen man das durch den Tumor „abgeschaltete“ Immunsystem wieder aktivieren kann. Dazu zählen beispielsweise die PDL1-Inhibitoren wie das Nivolumab oder Pembrolizumab. In ersten Studien beim schwarzen Hautkrebs hat die Wissenschaft damit neue Erfolge erzielt, die sich auch auf andere Tumorentitäten, wie zum Beispiel das nichtkleinzellige Lungenkarzinom, das Blasenkarzinom oder hämatologische Erkrankungen übertragen lassen. Wenn Standardtherapien nicht mehr wirksam sind, können wir zudem durch Verfahren der molekulargenetischen Charakterisierung der Tumoren, etwa das Next Generation Sequencing (NGS), erkennen, welches die sogenannten „Treibermutationen“ im Tumor sind. Daraus können wir auf einen passenden Wirkstoff rückschließen.
Inwiefern wird die Immuntherapie in der Onkologie Ihrer Ansicht nach künftig allgemein eine größere Rolle spielen?
Die Immuntherapie spielt jetzt schon eine sehr große Rolle. Durch die Checkpoint-Inhibitoren haben wir heute Erstlinien-Therapie-Optionen, von denen wir früher kaum zu träumen wagten. Wir kommen jetzt in den Bereich der Zelltherapie, durch die wir in der Lage sind, Immunzellen so zu verändern, dass sie Tumoren gezielt attackieren. Die ersten Zulassungen in den USA sind schon erfolgt, und es wird auch in Deutschland nicht mehr lange dauern, bis wir diese Therapien, zunächst bei hämatologischen Indikationen, einsetzen können. Die Immuntherapie wird künftig unabhängig von den anderen aktuellen Strategien bei onkologischen Erkrankungen eine wichtige Rolle spielen. Ich denke, sie hat eine große Zukunft.
Was wird in den nächsten Jahren realistischerweise aus Ihrer Sicht kommen?
Der Einsatz der Zelltherapie wird bei hämatologischen Erkrankungen zum Standard werden, wahrscheinlich nicht nur in refraktären Situationen, sondern bereits in früheren Therapielinien. Ich denke, dass auch eine Tumor-Vakzinierung kommen wird, Stichwort „Auto-in-vito-Vakzinierung“, durch die man den Tumor so dem Immunsystem präsentiert, dass eine lang anhaltende Immunantwort entsteht und systemische Metastasen behandelt werden können. Bei welchen Entitäten das funktioniert, müssen wir noch sehen und auch die Langzeit-Toxizität und das Nebenwirkungs-Management muss noch geprüft werden.
Kontakt für Ärztinnen und Ärzte: Tel.: +49 (0)89-4400-74768 Fax: +49 (0)89-4400-74776 E-Mail: lars.lindner@med.uni-muenchen.de
Das Gespräch führte Stephanie Hügler
